Equipements de l'UMR_S 999 : 
Lecteur de plaques EnVision 2103 (Perkin Elmer)
Lecteur multimode FlexStation 3 (Molecular Devices)
Biophotometer D30 (Eppendorf)
Système de PCR-Q en temps réel StepOne+ (Applied Biosystems)
Thermocyleur T100 PCR (Bio-Rad)
Système hypoxie in vitro (Coy Laboratory)
Système Shear Stress (Ibidi)
Système de cytomètrie de flux MacsQuant (Miltenyi)
Dosage multiplexing Ella (ProteinSimple)
Western Blot automatisé Jess (ProteinSimple)
Système ChemiDoc (Bio-Rad) de détection multiple : fluorescence, colorimètrie, densitomètrie, chemiluminescence
Microscopes de routine (Nikon & Zeiss)
Imagerie ionique inversée IX71 non motorisée (Olympus)
Microscopie confocale LSM 900 (Zeiss)
2 Chambres hypoxiques pour rongeurs
Echographe Vevo3100 LT et station d'imagerie dédiée (VisualSonics - Fujifilm)
Plateau hémodynamique pour rongeurs
Analyseur d'hématologie Element HT5 (Heska)
L'unité Inserm possède 2 microscopes de routine équipés pour l'acquisition d'images en fond clair et en épifluorescence.
SYSTEME DE DETECTION MICROPLAQUE MULTIMARQUAGE ENVISION XCITE MONO DETECTEUR : Envision 2103
Ce lecteur de microplaques utilise 4 modules optiques dits « optimisés » interchangeables.
PC de contrôle instrument sous Windows XP
�Logiciel Wallac 2100 Manager
� Module général simple longueur d'onde Fluorescence
� Module général simple longueur d'onde Absorbance
� Microplaque test multi-technologie (2009-0020)
Unité de détection :
� Photométrie: Photodiode Haute-Sensibilité : 230 - 950 nm
� Fluorescence, Fluorescence en temps retardé et Luminescence : PMT à courbe de réponse élargie (Type Hamamatsu R6358 P)
Filtre absorbance 405 nm Réf 2100-5200
Filtre Absorbance/Fluorescence 450 nm
Filtre Absorbance/Fluorescence 492 nm
Filtre Absorbance/Fluorescence 590 nm
Module dédié technologie ALPHASCREEN (montage usine)
Comporte les éléments suivants
� LASER d'excitation
� Module dichroique
� Filtres
� Canal optique dédié
� Stabilisateur de température de lecture de microplaque
inventaire des éléments installés:
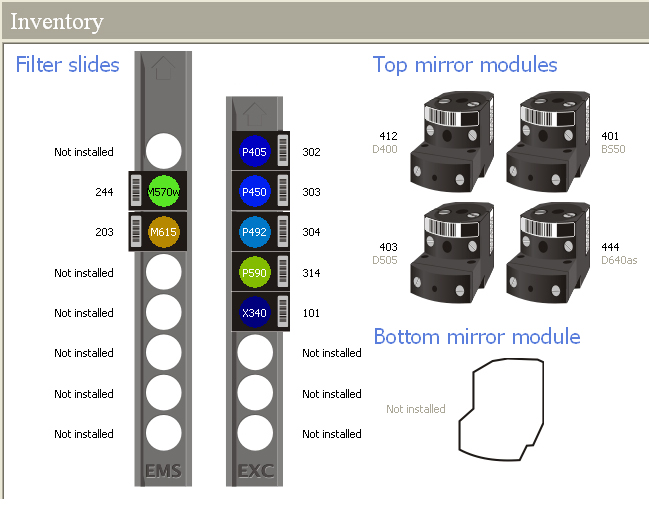
Stabilisateur de température de lecture de microplaque
Source d'excitation :
Lampe flash Xénon Gamme spectrale 230-850 nm
Barrette de filtres d'excitation à 8 positions (Ø 15 mm)
Barrette de filtres d'émission à 8 positions (Ø 15 mm)
FlexStation 3
La plateforme FlexStation 3 offre aux chercheurs la possibilité d’étudier un large éventail de paramètres biologiques à la fois sur des extraits biochimiques mais aussi sur des cellules vivantes. La force et l’originalité de la plateforme FlexStation 3 repose sur l’association d’un lecteur multimode très performant à un robot manipulateur-pipetteur multicanaux. Elle permet ainsi de mesurer de façon automatisée et à haut débit un large éventail de paramètres biologiques et d’étudier leurs cinétiques sur des temps très courts de l’ordre de la seconde.
Un lecteur multimode très performant :
Le lecteur multimode de la FlexStation 3 (5 modes) permet de détecter une large gamme d’absorbance, de fluorescence (intensité, polarisation ou « time-resolved » fluorescence) et de luminescence. Deux monochromateurs permettent de déterminer les longueurs d’onde optimales d’excitation et d’émission en sélectionnant avec un incrément de 1.0 nm des longueurs d’onde comprises entre 200 et 1000 nm. Les mesures peuvent s’effectuer dans des plaques multi-puits de formats variés (6, 12, 24, 48, 96- and 384-well).
Un robot manipulateur-pipetteur multi-canaux :
Le robot manipulateur-pipetteur multicanaux permet la distribution automatique de réactifs ou de drogues dans des puits de culture de 96- et 384-puits. Cela permet de maîtriser les temps d’ajouts des drogues, de minimiser les erreurs de pipetage et offre ainsi un outil performant pour les études à haut débit. La distribution des liquides se fait via des pipettes multi-canaux intégrées permettant la distribution simultanée de drogues dans 8 ou 16 puits de manière simultanée. Les changements dans les paramètres étudiés sont mesurés quasi simultanément à l’ajout des drogues ce qui permet de suivre en temps réel (de l’ordre de la seconde) l’évolution du paramètre biologique étudié.
La FlexStation 3 est thermostatée (jusqu’à 45°C) ce qui permet de maintenir une température de 37°C permettant les études sur cellules vivantes.
Applications :
La FlexStation 3 peut ainsi être utilisée pour l’étude dynamique en temps réel de divers paramètres sur cellules vivantes ou extraits biochimiques : mesure de flux calciques ou de nucléotides cycliques, de potentiels de membrane, de cinétiques enzymatiques, d’incorporation d’acides gras, de capture de neurotransmetteurs, d’activité de protéines kinase/phosphatase, de l’activité de gènes rapporteurs (dual luciférase)….

Imagerie ionique : microscope inversé
Ce système permet de suivre les flux ioniques de type calciques dans des cellules en culture chargées de fluorophore (Fura-2, Mag-Fura-2, Indo-1, ...) et d'enregistrer les courants ioniques par la technique du Patch clamp. Les cellules peuvent être stimulées électriquement lors des enregistrements.
Un système de perfusion permet l'application de substances diverses. Le chauffage de la chambre d'enregistrement permet de travailler dans des conditions proches des conditions de température physiologique.

Caractéristiques du système
Microscope : Olympus inversé IX71 non motorisé
un condenseur DIC
Sources lumineuses :
Monochromateur Polychrome V (TILL Photonics)
Lampe halogène 12V pour la transmission + obturateur Uniblitz
Objectifs : Olympus
- Plan Apochromat 10 X, ouverture numerique 0.40
- Plan semi Apochromat 40 X long working distance, ouverture numerique 0.60
- UV Apochromat 40 X immersion à huile ouverture numérique 1.35, spécial excitation UV à 340 nm
- Plan semi Apochromat 60 X immersion à huile ouverture numérique 1.25
- Lentille type Optovar 1.6x
Filtres dans le statif :
- FITC : HQ480/40x, Q505LP, HQ535/50m
- Fura-2 : pas de filtre d'excitation, 400DCLP, D510/80m
- Indo-1 : D365/10x , 380DCLP
Filtres dans le Dual View (pour acquisitions simultanées):
- Fura 2 / IR visible: D520/60m, 565ldx, D660p/10m
- Indo1 (2 émissions): D405/30m, 440dclp, D485/25m
Caméra :
CCD CoolSnap HQ monochrome (Photometrics)
Logiciels :
Metamorph et Metafluor (Molecular Devices)
Axon pClamp 10
Electrophysiologie :
Micro-manipulateur Exfo Burleigh
Axopatch 200B
Digidata 1440
Stimulateur électrique HAMEG
Accessoires :
Chauffe-objectif 40x huile
Chauffage de la chambre d'observation
Système de perfusion
Chambres de perfusion pour lamelles de 15, 18 et 25 mm
Microscopie confocale
Le microscope confocal LSM 700 (Zeiss) permet d'acquérir des images confocales en fluorescences multiples sur des cellules fixées ou vivantes et coupes de tissus. Des expériences de FRAP, photoactivation and photoconversion peuvent etre réalisées.
La spécificité du signal peut être vérifiée par une analyse spectrale.
Des analyses de colocalisation sont possibles en post-acquisition.

Caractéristiques du système
Sources lumineuses :
Lampe HBO, lampe halogène et banc de diodes lasers à 405, 488, 555 et 639 nm
Microscope: Zeiss Axio Observer Z1 inversé, entièrement motorisé + DIC
LSM 700 : 2 photomultiplicateurs pour la fluorescence + un photomultiplicateur de transmission
platine motorisée en x, y, z
Objectifs:
- Acroplan 20x/0,45
- Plan-Néofluar 40x/1,30 oil
- Plan-Apochromat 63x/1,40 oil
Filtres:
- Zeiss set 49 DAPI : G 635, FT 395, BP 445/50
- Zeiss set 43 TRITC: BP 545/25, FT 570, BP 605/70
- Zeiss set 44 FITC: BP 475/40, FT 500, BP 530/50
Logiciel :
ZEN (Zeiss)

Cellules Caco2, marquage des noyaux au DAPI (bleu) et d'une protéine de transport du Magnésium (vert) x40.
Microdissection laser
Le microdissecteur PALM MicroBeam (Zeiss) permet de microdisséquer des coupes de tissus ou des cellules vivantes en culture et de catapulter les échantillons découpés directement dans le tube collecteur à l'aide du laser.
Suite à la microdissection, des analyses sur l'ADN, l'ARN , les protéines ou les cellules vivantes peuvent être réalisées.

Caractéristiques du système
Sources lumineuses :
Lampe HBO
Lampe halogène
Laser pour la microdissection
Microscope: Zeiss Axio Observer Z1 inversé, entièrement motorisé + DIC
Caméras :
AxioCam MRm monochrome sensible aux faibles intensités lumineuses.
AxioCam CC1 couleur
Système de lumière structurée APOTOME
Objectifs:
- Plan-Néofluar 2.5x/0.07
- Fluar 5x/0.25
- Plan-Néofluar 20x/0.4 Korr
- Plan-Néofluar 40x/0.6 Korr
Platine motorisée en x, y, z
Filtres
- Zeiss set 49 DAPI : G 635, FT 395, BP 445/50
- Zeiss set 43 HE TRITC: BP550/25, FT 570, BP 605/70
- Zeiss set 38 HE FITC: BP 470/40, FT 495, BP 525/50
Logiciels :
Palm Robo software 4.5 pour la microdissection
Axiovision 4.8 : modules de colocalisation, Inside4 (reconstitution 3D avec rendu surfacique), MosaiX, Mark & find.
Accessoires :
Robomover pour la collecte des échantillons après catapultage
Collecteurs : 1x200, 8x200µl, livecell
Supports : slideholder triple, dishholder 50cc


Photos de la microdissection d'un glomérule rénal
Laboratoire de préparation
Ce laboratoire permet à la plateforme d'imagerie cellulaire d'être indépendante des laboratoires de l'unité quant à la préparation des échantillons pour un travail optimisé.
Culture cellulaire: 
Hotte à flux laminaire
Incubateur à CO2
Microscope (Leica)
Système d'isolement de cardiomyocytes
par perfusion rétrograde de type Langendorff.
Electrophysiologie: 
Etireuse (Zeitz) et polisseur
Microtome à lame vibrante (Microm)
Préparation pour histologie ou microdissection:
Cryomicrotome (Leica)
UV Stratalinker 2400 (Stratagene) pour la préparations des lames de microdissection
Vibratome
Autres: 
Centrifugeuse et micro-centrifugeuse, vortex et agitateurs magnétiques
Système de purification d'eau
pH-mètre
Pipettes automatiques et pipeteurs
Loupe binoculaire
Bain-marie
Réfrigérateur / congélateur
Analyses d'images
Toutes les données et images acquises sur les microscopes de la plate-forme peuvent être analysées sur des postes spécifiques dotés des logiciels adéquats.
Ordinateur 1 : analyse d'images
Logiciels :
Metamorph et Metafluor Offline
LSM browser
Zen LE
Axiovision LE
Image J
Microsoft Office
Ordinateur 2 : analyse de l'échocardiographie
Echopac workstation
Package quantification avancée pour echopac
Package 4D (Tomtech)












